隨著國內外制藥公司在研發方面的不斷努力,全球細胞治療賽道正加速進入收獲期。
近日,復星凱特宣布發布其 CAR-T 產品阿基侖賽注射液(商品名:奕凱達?)用于治療一線免疫化療無效或一線免疫化療后 12 個月內復發的成人大 B 細胞淋巴瘤(r/r LBCL)的上市注冊申請最近獲得了國家藥監局附條件批準。這也標志著奕凱達?二線適應癥正式上市。

隨后,國家藥監局批準了馴鹿生物申報的 BCMA CAR-T 產品伊基奧侖賽注射液(商品名:福可蘇?),該產品在市場上用于治療既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)的復發或難治性多發性骨髓瘤(RRMM)成人患者。這是國內首個獲批的 BCMA 靶向 CAR-T 療法,也是國內首款自主研發獲批上市的 CAR-T 產品。
除了獲準在腫瘤領域上市外,細胞治療在糖尿病領域也取得了突破。美國食品和藥品監督管理局(FDA)最近宣布,已批準 CellTrans 公司開發的同種異體胰島細胞療法Lantidra上市,用于治療 I 型糖尿病。根據公開信息,Lantidra 是一種將供體胰腺細胞輸送到肝臟主靜脈的單次輸注藥物。接受這種治療的患者必須服用免疫抑制藥物,以防止其免疫系統損傷分泌胰島素的供體細胞。目前,Lantidra 被批準用于那些盡管進行了嚴格的糖尿病管理但仍反復出現嚴重低血糖的 I 型糖尿病患者。

在該消息宣布后不久,禮來與其糖尿病細胞治療合作伙伴 Sigilon Therapeutics 聯合宣布,禮來將以超過 3 億美元的價格收購后者。Sigilon 是一家致力于為各種急性和慢性疾病患者開發功能性治愈療法的公司。

從跨國糖尿病巨頭禮來的布局來看,細胞療法在糖尿病市場前景可觀。華中科技大學血液病學研究所副所長梅恒在接受 21 世紀經濟報道記者采訪時表示,細胞療法在代謝性疾病方面具有巨大的市場潛力。
“糖尿病是胰島細胞出了問題,無論是哪種類型的胰島細胞,它們都與免疫功能的異常有關。如果免疫功能細胞被敲除,胰島功能可以重建,代謝性疾病也得到了有效治療。如果說抗體藥物在上個世紀改變了治療方法,那么在這個時代,精準的過繼性細胞免疫療法可能為治療帶來新的突破。”梅恒說。
糖尿病迎來細胞療法
糖尿病是世界上導致死亡和殘疾的第八大原因,影響著各國、各年齡組和不同性別群體。全球這種疾病患者數量的指數級增長對全世界公共衛生和醫療保健系統構成了緊迫的挑戰。
英國《柳葉刀》周刊和《柳葉刀·糖尿病與內分泌學雜志》最近發表的一系列關于全球和美國糖尿病問題的文章指出,到 2050 年,全球糖尿病患者人數預計將超過 13.1 億,這將在未來幾十年產生持久影響,包括種族和地理區域在內的全球結構性不平等正在迅速加劇這場危機。糖尿病作為一個重大的全球公共衛生問題,給醫療保健系統帶來了沉重的負擔。此外,根據國際糖尿病聯合會的數據顯示,2021 年糖尿病導致的全球衛生支出約為 9660 億美元;預計到 2045 年,這一數字將超過 10540 億美元。
I 型糖尿病是一種慢性疾病,通常發生在兒童和年輕人身上,它是由自身免疫系統攻擊胰島素產生細胞,導致胰島素缺乏而引起的。目前,一些 I 型糖尿病患者在使用胰島素預防高血糖時,往往會糾正到過低的血糖水平,從而導致低血糖。有些人可能會出現無意識低血糖,他們可能無法注意到血糖下降,因此無法采取干預措施防止血糖進一步下降。
美國食品藥品監督管理局生物制品評估與研究中心的 Peter Marks 在一份新聞稿中表示,患者嚴重低血糖是非常危險的,可能會導致意識喪失或癲癇發作,從而造成傷害。基于此,FDA批準的首個治療 I 型糖尿病的細胞療法有望為 I 型糖尿病患者和復發性嚴重低血糖患者提供更多的治療選擇,從而幫助患者達到理想的血糖控制水平。
公開資料顯示,Lantidra 細胞療法是從捐贈者那里提供胰腺組織,然后分離純化胰島細胞。目前,臨床上 90% 的胰島移植手術是經皮肝門靜脈穿刺注射胰島細胞,肝臟是這些移植物的新家園,存活的胰島細胞可以獨立調節血糖水平。術后免疫抑制治療是必要的。
FDA 對 Lantidra 細胞療法的批準主要基于兩項臨床試驗。在這兩項試驗中,30 名參與者接受了一到三次藥物注射。大約 70% 的人在 1年或更長時間內不再需要注射胰島素,30% 的人在 5 年以上的時間內不再不需要注射胰島素。
在 Lantidra 獲批上市之際,許多公司也在加快布局。美國國立衛生研究院臨床試驗注冊網站 ClinicalTrials 顯示,截至目前,全球正在開展 351 項細胞治療糖尿病的臨床試驗。
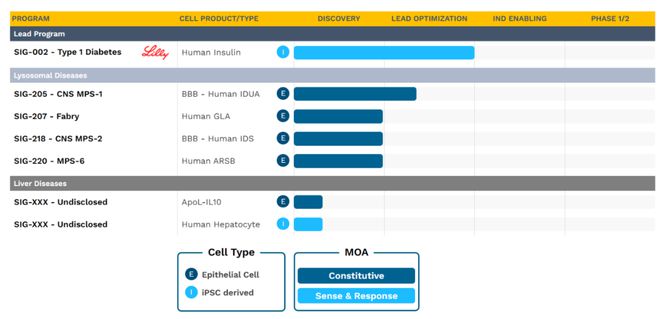
其中,禮來的合作伙伴 Sigilon Therapeutics 是強勁的布局者之一。早在 2018 年,禮來就向 Sigilon 提供了 6300 萬美元的初始投資和股權投資,將其研究療法開發成 I 型糖尿病的功能性治療。SIG-002 是禮來與 Sigilon 合作的主要資產,預計將在今年 IND 之前完成驗證研究,并于 2024 年提交給 IND。
根據此次公開收購的條款,禮來將以每股 14.92 美元的價格收購流通股票,外加每股 111.64 美元收購不可交易的有價值權利,交易總額超過 3 億美元。消息公布后,Sigilon 的股價在交易前飆升了 470%。這筆交易預計將于今年第三季度完成。
一位券商醫藥行業分析師對 21 世紀經濟報道記者表示,考慮到 2021 年中國糖尿病藥物市場規模已達到 670 億元左右,跨國藥企掘金 I 型糖尿病市場的前瞻性值得肯定。面對糖尿病領域巨大且未得到滿足的治療需求,糖尿病患者需要“更好的藥物”。然而,由于細胞治療藥物的高昂價格,既有高昂的定價體系,也有巨大的市場需求。作為一種高價藥,如何將其商業化,進一步搶占市場份額,也將成為企業未來需要關注的焦點。
創新療法落地商業化難度大
在糖尿病布局上,除了細胞治療,禮來還持有 Trulicity(度拉糖肽)、Mounjaro(替爾泊肽)、Humulin(重組人胰島素)、Humalog(賴脯胰島素)和Jardiance(恩格列凈)。根據禮來公司發布的 2022 年財報數據顯示,該公司全年總收入為 285.41 億美元,同比增長 1%。糖尿病業務組合貢獻了 138.29 億美元的收入,占禮來總收入的 48.5%。
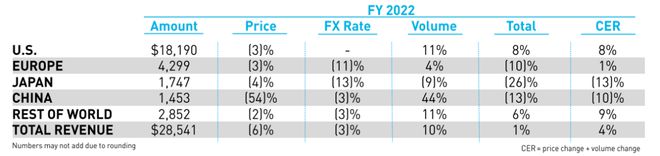
但需要注意的是,禮來 GLP-1 受體激動劑度拉糖肽的增長率自 2021 年以來有所下降。其競品諾和諾德 GLP-1 業務的年收入為 833.71 億丹麥克朗(約合 122.44 億美元),同比增長 56%。此外,有業內人士認為,到 2030 年,I 型糖尿病的市場規模有望超過 70 億美元,禮來自然不會缺席,細胞治療的布局也將成為禮來糖尿病新的市場增長點。
然而,細胞治療市場并不像想象中那么容易。在談到細胞治療的市場前景時,一位藥企高管在接受 21 世紀經濟報道記者采訪時表示,在臨床治療領域,細胞治療肯定會成為越來越主流的治療方法,但目前行業發展還處于早期階段。細胞治療是一種技術復雜、生產成本高、相對個性化的治療方法,對于患者的可及性和整個市場的未來規模方面還存在一些不確定性。
根據弗若斯特沙利的數據,自 2015 年以來,全球細胞治療行業一直在快速發展。從 2016 年到 2020 年,市場規模從 5040 萬美元增加到 20.8 億美元,預計到 2025 年,全球細胞治療市場規模將達到近 305.4 億美元。盡管在中國進行的臨床研究很多,但在中國推出并商業化的產品很少,這也反映了研究和產出之間的不平衡。
此外,據沙利文統計,截至 2022 年 11 月底,國家藥品監督管理局已批準 200 多個用于細胞基因治療的新藥臨床試驗許可證,但只有極少數推進至注冊臨床 II 期或關鍵臨床研究階段。細胞治療藥物的適應癥分布也集中在癌癥領域。如何在競爭中脫穎而出,快速推進注冊臨床研究,并在未來取得商業成功,是許多企業需要考慮的重要問題。
從研發渠道來看,醫藥行業約 13% 的產品屬于細胞療法,但目前產品數量不足 1%。該行業仍處于快速增長階段,是繼小分子和大分子之后的跨代類別。例如,我們還需要關注細胞治療產品擴展在新適應癥和工藝創新方面的進一步突破。這家制藥公司的高管強調,細胞治療的成本仍然很高,提高患者的用藥可及性仍然是一個主要方向。下一步,需要進一步關注擴大市場應用前景,行業需要在腫瘤的基礎上進一步探索更多疾病領域的發展可能性。
此外,上海藥品審評核查中心副主任李香玉此前指出,細胞治療產品已經走過了業內人士質疑其安全性和有效性的階段。在企業開發的細胞基因治療產品的安全性和有效性得到提高后,近年來批準的基因治療產品數量有所增加。在現有的細胞治療市場中,絕大多數商業化和市場化的細胞治療產品都是針對相對集中的靶點,這也引起了人們對差異化靶點產品的關注。
“需要注意的是,國家層面對細胞基因治療產品的監管也越來越嚴格。例如,細胞治療產品的 GMP 與傳統生物制品相比具有一定的特異性,例如一次性裝置的數量多,并且生產過程應注重剪切力。此外,還要考慮細胞的穩定性、工藝的穩定性和供體的變異性。”李香玉強調。
公司如何應對這些情況?上述分析師還指出,中國細胞治療產品之所以無法進入紅海市場,是因為與抗體藥物和化學靶向藥物相比,研發壁壘相對較高。然而,許多制藥公司在申報注冊臨床-注冊臨床-獲批上市等各種環境中都面臨著工藝壁壘。這也使得不少藥企因為工藝不過關最終在審評環節終止,浪費了大量的精力和資源。此外,目前細胞治療的總體滲透率高于預期,但總體滲透率仍然很低。因此,企業在這一賽道上的布局仍需綜合考慮。
免責聲明:
我們尊重原創,也注重分享。圖文來源網絡,版權歸原作者所有,如涉及作品內容、版權或其它問題,請聯系我們刪除!


 閩公網安備 35020602002648 號
閩公網安備 35020602002648 號 QQ 客服
QQ 客服
